Hydrofluoric acid 氫氟酸、化骨水、氟化氫、氟化氫溶液 HF
Hydrofluoric acid 氫氟酸、化骨水、氟化氫、氟化氫溶液 HF
氫氟酸是氟化氫氣體的水溶液,具有強烈的腐蝕性,清澈,無色、發煙的腐蝕性液體,有劇烈刺激性氣味,純氟化氫也稱作無水氫氟酸。熔點 -83.3℃,沸點 112.2℃,密度 0.988g/cm³。易溶於水、乙醇,微溶於乙醚。因為氫原子和氟原子間結合的能力相對較強,使得氫氟酸在水中不能完全電離,所以理論上低濃度的氫氟酸是一種弱酸。
氫氟酸是劇毒,如吸入蒸氣或接觸皮膚會造成難以治癒的灼傷。
因為氫原子和氟原子間結合的能力相對較強,使得氫氟酸在水中不能完全電離,氫氟酸是一種弱酸,具有極強的腐蝕性,能強烈地腐蝕金屬、玻璃(二氧化矽)和含矽的物體,正因如此,它必須儲存在塑料容器中(聚四氟乙烯)。如果要長期儲存需要密封容器,而且容器應儘可能真空,因為氫氟酸能夠溶解絕大多數無機氧化物。
氫氟酸與二氧化矽反應方程式如下:
SiO2+6HF→H2[SiF6]+2H2O
以上反應分兩步進行:
SiO2+4HF→SiF4↑+2H2O
SiF4易溶於水,與HF繼續反應:
SiF4+2HF→H2[SiF6]
氫氟酸生產製成:
實驗室一般用螢石(氟化鈣 CaF2)和濃硫酸來製造氫氟酸,需要密封在塑料瓶中,並保存於陰涼處。
加熱到250攝氏度時,這兩種物質便反應生成氟化氫。反應方程式為:
CaF2+H2SO4→2HF+CaSO4
這個反應生成的蒸氣是氟化氫、硫酸和其他幾種副產品的混合物。在此之後氟化氫可以通過蒸餾來提純。工業上的氫氟酸是通過用酸分解磷灰石獲得的。
用途:
氫氟酸具溶解氧化物的能力,它在鋁和鈾的提純中起著重要作用。氫氟酸也用來蝕刻玻璃、雕刻圖案、標註刻度和文字,半導體工業使用它來除去矽表面的氧化物,在煉油廠中它可以用作異丁烷和丁烷的烷基化反應的催化劑,除去不鏽鋼表面的含氧雜質的「浸酸」過程中也會用到氫氟酸。
氫氟酸也用於多種含氟有機物的合成,比如特氟隆(聚四氟乙烯),還有氟利昂一類的致冷劑。
安全性:
在人體內部,氫氟酸與鈣離子和鎂離子反應,正因為如此,它會使依靠以上兩種離子發揮機能的器官喪失作用。接觸、暴露在氫氟酸中一開始可能並不會疼痛,而徵狀可能直到幾小時後氫氟酸與骨骼中的鈣反應時才會出現。如果不進行處理,最終可能導致心、肝、腎和神經系統的嚴重甚至是致命損傷。故又稱化骨水。
接觸氫氟酸後的初始救護措施通常包括在接觸部位塗上葡萄糖酸鈣凝膠。如果接觸範圍過廣,又或者延誤時間太長的話,醫護人員可能會在動脈或周圍組織中注射鈣鹽溶液。但無論如何,接觸氫氟酸後必須得到及時並且專業的護理。
即使能得到及時治療,身體表面少於10%的面積暴露在氫氟酸中也會是致命的。吞服高濃度的氫氟酸溶液會導致急性的低血鈣症,引致心臟停搏及死亡。
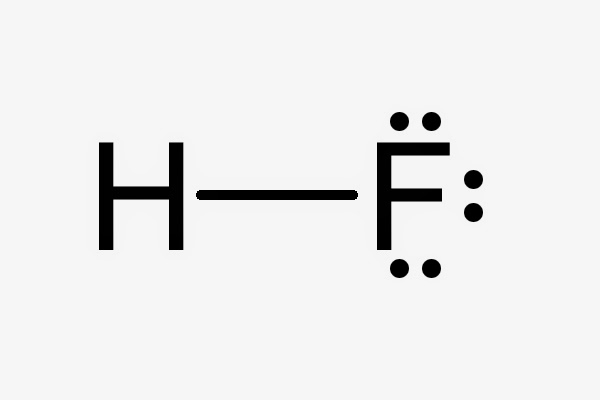


留言
張貼留言