Sulfur dioxide 二氧化硫;亞硫酐 SO2
Sulfur dioxide 二氧化硫;亞硫酐 SO2
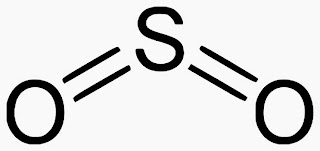
二氧化硫(sulphur dioxide , sulfur dioxide)化學式SO2,無色氣體或液體,有刺激性氣味。比重1.434(0℃),熔點-73℃,沸點-10℃。溶於水、乙醇、乙醚。為硫化鐵礦於特種爐內焙燒而得。其氣體易為冰與鹽冷卻為液體,或於三大氣壓下液化。用為試藥、漂白劑、保藏劑、殺蟲劑,並精製火油及潤滑油料。
大氣主要污染物之一,在許多工業過程中也會產生二氧化硫,由於煤和石油通常都含有硫化合物,因此燃燒時會生成二氧化硫。當二氧化硫溶於水中,會形成亞硫酸(酸雨的主要成分)。若把SO2進一步氧化,通常在催化劑如二氧化氮的存在下,便會生成硫酸。
二氧化硫可通過燃燒硫獲得:
S8 + 8O2 →8SO2
2H2S(g) + 3O2(g)→2H2O(g) + 2SO2(g)
二氧化硫的抗菌性質,它有時用作干杏和其它乾果的防腐劑,用來保持水果的外表,並防止腐爛。二氧化硫的存在,可以使水果有一種特殊的化學味道。
二氧化硫是釀酒時非常有用的化合物,作為抗生素和抗氧化劑,防止酒遭到細菌的損壞和氧化。它也幫助把揮發性酸度保持在想要的程度。酒中允許的SO2濃度的上限在美國為350ppm,而在歐盟,紅酒為160ppm,白酒為210ppm。如果SO2的濃度很低,那麼便很難探測到,但當濃度大於50ppm時,用鼻子就能聞出SO2的氣味,用舌頭也能品嘗出來。
二氧化硫還是一個很好的還原劑。在水的存在下,二氧化硫可以使物質褪色。特別地,它是紙張和衣物的有用的漂白劑。這個漂白作用通常不能持續很久。空氣中的氧氣把被還原的染料重新氧化,使顏色恢復。
二氧化硫還用來製備硫酸,首先轉化成三氧化硫,然後再轉化成發煙硫酸,最後轉化成硫酸。這個過程中的二氧化硫是含硫礦物與氧氣反應產生的。把二氧化硫轉化成硫酸的過程,稱為接觸法。
二氧化硫容易液化,且汽化熱很大,因此適合作為製冷劑。在氟利昂的發展之前,二氧化硫就曾經用作家用冰箱的製冷劑。
二氧化硫液態是萬用的惰性溶劑,廣泛用於溶解強氧化性鹽。有時也用作有機合成中磺醯基的來源,把芳基重氮鹽用二氧化硫處理,便可獲得對應的芳基磺醯氯。
二氧化硫用來處理城市的污水排放前的氯化污水。二氧化硫與氯氣反應,氯氣被還原,生成Cl−。
CAS號: 7446-09-5
MDL號: MFCD00011450
EINECS號: 231-195-2
RTECS號: WS4550000
BRN號: 3535237
PubChem號:


留言
張貼留言